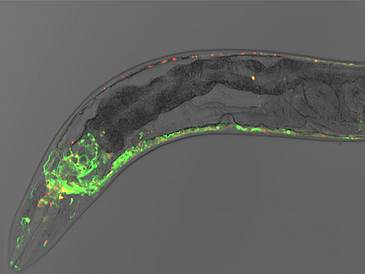
Proteine sind überlebenswichtig und übernehmen vielfältige Aufgaben in jeder Zelle. Sie katalysieren Reaktionen, transportieren Stoffe, bilden das Zellskelett und ermöglichen Bewegungen wie Muskelkontraktionen. Es gibt Proteine in unseren Zellen, die sind sehr kurzlebig und nur für Minuten oder wenige Stunden aktiv, andere sind Monate oder gar Jahre aktiv. Warum ist das so und durch welche Faktoren wird die Lebensspanne eines Proteins reguliert? Und welchen Einfluss hat das Alter des Organismus oder der Zelle auf die Lebensspanne des Proteins?
Um diese Fragen zu beantworten, wollen Prof. Dr. Janine Kirstein von der Universität Bremen und Dr. Tim Clausen vom Institut für Molekulare Pathologie (IMP) in Wien in einem gemeinsamen Projekt die Lebensspanne, d.h. Synthese, Faltung, Aktivität und schließlich den Abbau des Muskelproteins Myosin im Fadenwurm (Nematode) Caenorhabditis elegans untersuchen.
Warum das Protein Myosin?
Im Unterschied zu anderen Proteinen ist den Forscher:innen zufolge über den Alterungsprozess des Proteins Myosin wenig bekannt: „Die Faltung von Proteinen wurde für aggregations-anfällige toxische Proteine, die Krankheiten wie Alzheimer auslösen können, bereits intensiv analysiert. Wir wissen jedoch recht wenig darüber, wie die Lebensspanne von Proteinen reguliert wird, die physiologische Aufgaben in unserem Körper übernehmen“, erläutert Professorin Kirstein. „Und dennoch sind über 1.000 Mutationen in Myosin bekannt, die zu Defekten in ihrer Funktionalität und damit zu Krankheiten führen.“
Wegen seiner Eigenschaften ist der Fadenwurm für das Vorhaben „Pro-Watch: Analyse der Proteinlebensspanne in alternden Nematoden“ besonders gut geeignet. „Der Nematode ist transparent und ermöglicht damit, über Fluoreszenzsensoren, die Synthese, Faltung, Aktivität und Abbau des Myosins am lebenden Tier zu untersuchen. Der Wurm ist mit ca. 25 Tagen kurzlebig. Das Leben verläuft sozusagen im Zeitraffer und lässt Einblicke in die Entwicklung, adulte Phase bis zum Ende des Zellwachstums und schließlich dem Versterben des Organismus innerhalb eines Monats zu.“
Kirstein und Clausen planen, einen fluoreszenzbasierten Sensor zu entwickeln, der erstmalig ein gleichzeitiges Messen der wichtigsten Parameter der Proteinlebensspanne von Myosin ermöglicht. Die gewonnenen Erkenntnisse können auf andere Proteine übertragen werden, um ein grundsätzliches Verständnis zum Wechselspiel zwischen Proteinalterung und dem Altern des gesamten Organismus zu erlangen.
Über Allen Distinguished Investigator
Das Allen Distinguished Investigator Programm wurde 2010 von dem verstorbenen Microsoft Co-Gründer und Philanthropen Paul G. Allen ins Leben gerufen, um kreative, frühzeitige Forschungsprojekte in der Biologie und der medizinischen Forschung zu unterstützen. In den vergangenen zwölf Jahren wurden insgesamt 130 Allen Distinguished Investigators ernannt. Jede Auszeichnung erstreckt sich über eine dreijährige Forschungsförderung.
Weitere Informationen:
PRO-Watch: an approach to monitor protein lifespan in aging worms / Pro-Watch: Analyse der Proteinlebensspanne in alternden Nematoden/Fadenwürmern:
https://alleninstitute.org/what-we-do/frontiers-group/distinguished-investigators/investigators/
https://www.uni-bremen.de/en/zellbiologie
Fragen beantwortet:
Prof. Dr. Janine Kirstein
Universität Bremen
Biologie/Chemie
Tel.: +49 421 218-62880
Email: kirsteinuni-bremen.de